¡Hola Amigos! En esta oportunidad quiero compartir con todos ustedes un tema el cual he podido estudiar a través de mis pasantías en Microbiología de Alimentos; se trata de una bacteria que tiene la capacidad de producir una enterotoxina en el hombre y causarle intoxicación, como es el caso de Staphylococcus aureus.
Staphylococcus aureus es una bacteria muy habitual y presente en casi la mitad de la población mundial. Es una de las fuentes más habituales de contaminación alimentaria y, por lo tanto, un punto al que el manipulador de alimentos debe prestar una especial atención.
En el primer post pudimos conocer las generalidades de este microorganismo, la forma en que puede contaminar los alimentos, los síntomas asociados y las medidas de prevención.
En esta segunda parte nos enfocaremos en estudiar la forma en que se puede identificar este microorganismo y aquellas pruebas necesarias para su confirmación en el laboratorio de Microbiología.
¡Espero les sea útil la información! Iniciemos.
DETERMINACIÓN DE S. aureus EN ALIMENTOS
Para la detección de Staphylococcus aureus en alimentos nos basaremos en la Norma Venezolana. Covenin 1292-89; la cual describe lo siguiente:
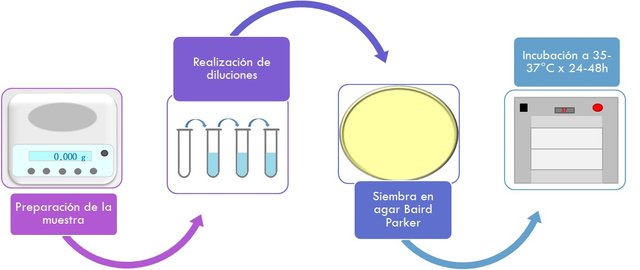
Preparación de la muestra:
- Consiste en pesar la cantidad según el producto que se esté analizando, en la mayoría de los casos corresponde a 25g de la muestra.
Asilamiento selectivo:
- Se debe utilizar un medio selectivo sólido, el cual inhibe el desarrollo de géneros diferentes al Staphylococcus, pero además permite reconocer el desarrollo característico del microorganismo buscado.
- Se agrega 1 ml de la muestra o diluciones de la misma sobre la superficie de los medios (agar Baird Parker) con la ayuda de una varilla de vidrio hasta la absorción completa.
- Incubación de las placas invertidas a 35-37°C durante 24-48 h.
- Al finalizar el período de incubación se eligen las placas que tengan 20-200 UFC con las características típicas: colonias negras, brillantes, rodeadas de una zona reducida blanca, y por una zona de aclaramiento que se extiende en el medio opaco.
RECUPERACIÓN DE LA CEPA
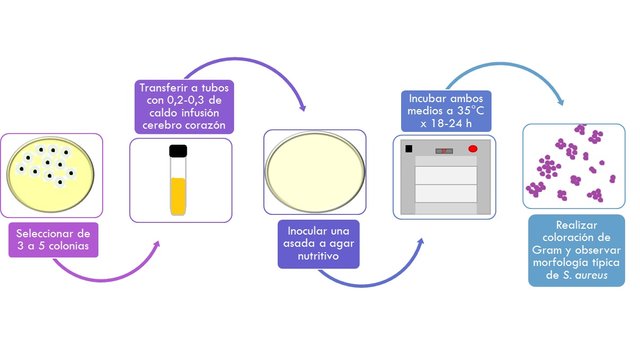
Este paso permite restaurar las células dañadas de Staphylococcus aureus
- Seleccionar al menos 2 colonias típicas de cada uno de los medios y se transfieren a 0,2 – 0,3 ml de caldo infusión cerebro corazón.
- Se siembra a continuación en un agar nutritivo tomando con la ayuda de un asa del caldo ICC (infusión cerebro corazón).
- Se incuban ambos medios a 35-37° x 18-24 h.
- Al final de la incubación se realiza una coloración de Gram con el cultivo de agar nutritivo; si se observa la morfología típica de S.aureus Cocos Gram Positivos de 0,8-1,0 um de diámetro, solos, en pares o más típicamente formando racimos de uva se procede a realizar la prueba de la coagulasa.
PRUEBA DE LA COAGULASA
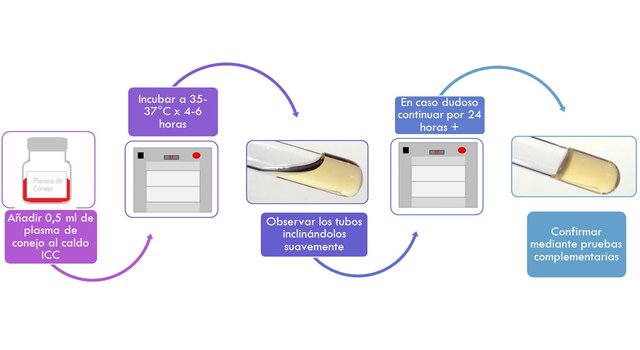
- Añadir 0,5 ml de plasma al cultivo ICC y se mezcla cuidadosamente.
- Se incuba a 35-37°C y se examina inclinando suavemente los tubos, durante un lapso de 6 horas para observar la formación de un coágulo.
- En caso dudoso se continua la incubación a la misma temperatura por no más de 24 h. para determinar el grado de positividad.
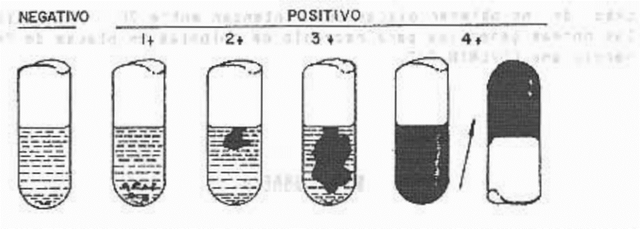
Se considera como positivo un coágulo de 3+ o 4+.
Negativo: no evidencia la formación de fibrina.
1+: pequeños coágulos dispersos.
2+: pequeños coágulos constituidos.
3+: coágulo grande bien constituido.
4+: contenido total del tubo de coagula y no se desplaza cuando se invierte el tubo.
PRUEBA DE LA TERMONUCLEASA
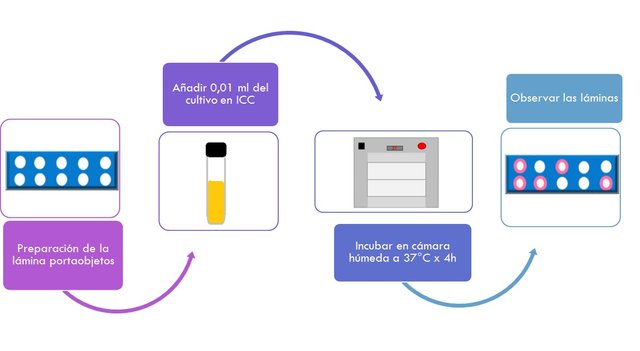
- Preparar una lámina portaobjetos añadiendo en la superficie 3ml de agar ADN-azul de toluidina.
- Cuando el agar solidifique realizar orificios de 2mm de diámetro sobre la superficie del mismo con ayuda de una pipeta Pasteur (10-12 orificios por lámina).
- Se remueven los pequeños tacos de agar por aspiración mediante vacío.
- Añadir a cada orificio aprox. 0.01ml del cultivo en caldo ICC previamente calentado en baño de agua hirviente por 15 min.
- Incubar las láminas en una cámara húmeda durante 4h a 37°C.
- Observar las láminas.
- Se considera un resultado Positivo la aparición de halos rosados que se extienden al menos 1mm desde la periferia de los orificios.
Nota: Ambas pruebas deben realizarse incluyendo controles negativos y cultivos controles de S.aureus positivos.
Queridos Amigos, hasta aquí la segunda parte, espero que les guste y sea de utilidad. ¡Hasta una próxima oportunidad!
REFERENCIAS
- Norma Venezolana. Covenin 1292-89. Alimentos. Aislamiento y Recuento de Staphylococcus aureus. Disponible en: http://www.sencamer.gob.ve/sencamer/normas/1292-89.pdf

Congratulations @estefanyd26! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
You can view your badges on your Steem Board and compare to others on the Steem Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPVote for @Steemitboard as a witness to get one more award and increased upvotes!
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
This post has been voted on by the SteemSTEM curation team and voting trail. It is elligible for support from @curie.
If you appreciate the work we are doing, then consider supporting our witness stem.witness. Additional witness support to the curie witness would be appreciated as well.
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit