En relación con la teoría atómica, la existencia de las moléculas no altera demasiado nuestra visión de la organización jerárquica, de la naturaleza a partir de los átomos iguales y los distintos tipos se combinan en unas porciones definida y originan las moléculas de los compuestos. Las reacciones químicas se explican al considerar la reorganización, ruptura o formación de moléculas, la combinación de átomos correspondientes a dos más elementos distintos.

Antoine Lavoisier (1743-1794 ), fuente de imagen de dominio de Wikimedia Commons
Ley de Lavoisier
En toda reacción química la masa de los reactivos es igual a la de los productos dela reacción, esta ley, si la observamos desde el punto de vista actual, es muy lógica no fue descubierta hasta el último cuarto del siglo XVIII, debido a las dificultades de medición, que existían en aquella época, principalmente en la medición de masa de los gases, dentro esta filosofía se consideraba una masa de hierro en el intemperie el observador veía, que a media que pasaba el tiempo el hierro se oxidaba, de tal forma se convertía en cal, según el lenguaje de aquel siglo y su masa iba creciendo mientras duraba la oxidación. Si reproducimos el mismo proceso dentro de un recipiente cerrado, la masa permanecerá invariable, es fácil comprender, que si pesamos el matriz, que contienen Zn en granalla junto con el embudo, que contiene ácido clorhídrico antes de la reacción y repetimos la operación después, la masa del hidrógeno, que se ha producido provocará una disminución de la masa del conjunto, pero la masa seria la misma si la prueba con el recipiente cerrado herméticamente.
Esta ley fue confirmada a través de los experimentos efectuados por Antoine-Laurent de Lavoisier, aunque había sido empleada como hipótesis, por otros químicos anteriores a él. La ley de conservación de la masa no es rigurosamente exacta para tenerlo claro.
Hoy en día se sabe, que la masa y la energía son mutuamente interconvertible de acuerdo con la ecuación de Eintein, E= mc2, donde E es la energía implicada en la trasformación, m es la masa y c es la velocidad de la luz, que vales 300.000 Km/s. en las reacciones químicas habitualmente las masas de los reactivos disminuyen entre 10^-9 y 10^-11g, cantidades que resultan totalmente inapreciables.
Un filósofo podría notar que, incluso después de haber contratado el principio el principio de la conservación de la masa, en un par de millones de reacciones, puede hallarse una concreta reacción, que false totalmente el principio: en sustancias, la hipótesis empírica y por tanto, no razón concluyente en contra, que se gane o se pierda peso en el curso delas reacciones químicas. Esta objeción será válida si la hipótesis de Lavoiser, hubiera quedado en el estado de hipótesis suelta, pero ha dejado de tener importancia en el momento mismo en, que la hipótesis ha sido teorizada.
La investigación científica: su estrategia y su filosofía - Página 684 por Mario Bunge – 2000.
También es vista desde otro punto, como en una reacción química los átomos no desaparecen, simplemente se ordenan de otra manera, Lavoisier tuvo que realizar numerosos y meticulosos experimentos para convencer a los que por entonces pensaban que al calentar un metal este ganaba masa cuando se convertía en una nueva sustancia. Lavoisier midió en un recipiente cerrado las masas del sólido y el aire antes y después de la combustión y llegó a la conclusión de que a masa que ganaba el metal era igual a la masa de aire que se perdía.
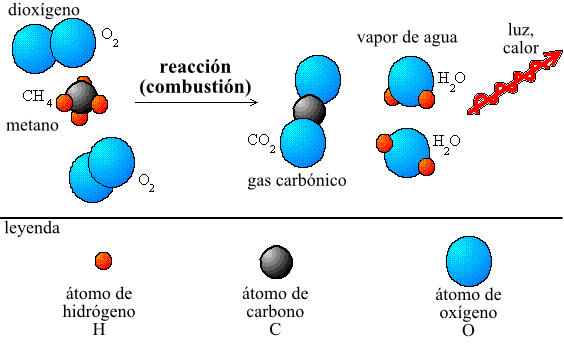
Unos de los ejemplo aparte de la hierro, fue el de la combustión de una vela, cuando arde no se gana ni se pierde masa. La masa total de la cera y del oxígeno molecular (O2) presente antes de la combustión es igual a la masa total de dióxido de carbono (CO2), vapor de agua (H2O) y cera sin quemar que quedan cuando la vela se apaga.
Masa de cera + masa de O2 = Masa de CO2 + Masa de H2O + Masa de cera sin quemar.
Hay que reconocer, que esta ley por este científico, nos brindas grandes aporte en el día de hoy en la química moderna, también se aplican como base de estudios de fotosíntesis, la combustión, la ley de conservación de la masa, la teoría calórica, la respiración animal, la oxidación de una fruta.
Bibliografía
La investigación científica: su estrategia y su filosofía - Página 684 por Mario Bunge – 2000.
La ley de Lavoisier: ensayos (y errores) 1998-2007 por Nicolás Alvarado – 2007.
Operaciones básicas del proceso, mezclas y disoluciones. QUIE0108 por Sergio Hurtado Melo – 2014.