Continuando con la explicación de los fundamentos de bioquímica, en este informe se expone la clasificación de los enlaces de acuerdo con la polaridad; y se explica, brevemente, cómo puede predecirse el carácter polar o no polar de una molécula. Todo ello se muestra en una ponencia dividida en cuatro subtítulos: polaridad de enlaces, polaridad de moléculas, electronegatividad y enlace iónico.
Esperando que este conocimiento teórico sea de gran utilidad para quienes lo necesiten y además, del agrado y el disfrute como lectura en cultura general para quienes lo puedan leer. ¡Gracias!
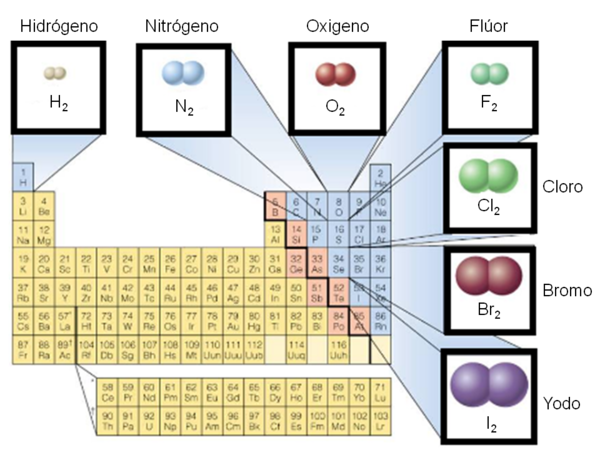
Polaridad de enlaces
“La polaridad de un enlace químico se da cuando existe una distribución asimétrica de la nube electrónica del enlace en torno a los dos átomos que forman dicho enlace. Esto sucede cuando ambos átomos tienen distinta electronegatividad...” ✱
Los electrones pueden ser compartidos por átomos desiguales, éste hecho nos obliga a buscar una explicación que aclare la distribución de la carga en un enlace. Para ello, se suelen clasificar los enlaces en polares y no polares; de esta última clase son los enlaces de las moléculas de H2 y Cl2; los enlaces de la molécula de HCl pertenecen a los enlaces polares.
Se denomina enlaces no polares a los H2 y Cl2 porque el centro de gravedad de la distribución de la carga negativa está en el centro de la molécula, ya que hay la misma probabilidad de encontrar el par de electrones junto a un núcleo que junto al otro. Cuando los dos átomos son de especies químicas diferentes (lado derecho de la tabla periódica), su electronegatividad atrae más fuertemente a los electrones de enlace, adquiriendo una carga parcial negativa que se representa por r-, mientras que el otro átomo que se representa por r+. Es decir, que el enlace tiene un polo negativo y un polo positivo. En este caso, se dice que se ha formado un enlace polar, o que el enlace posee polaridad. Mientras mayor sea la diferencia entre las electro negatividades de los átomos que forman el enlace químico, más polar será el mismo.
Polaridad de moléculas
Una molécula es polar, cuando el centro de carga negativa no coincide con el centro de carga positiva, por lo tanto la molécula posee dos polos y en consecuencia constituye un dipolo. Cuando la molécula es polar, su momento dipolar es diferente de cero.
Ejemplo:
La polaridad de una molécula y en consecuencia su momento dipolar es una combinación de las polaridades de los enlaces individuales. Por ejemplo la molécula de H2O (agua) presenta momento dipolar (µ = 1,84 D), por lo tanto es polar.
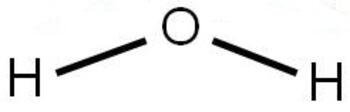
En el caso del HCl, el enlace se denomina polar porque el centro de la carga positiva no coincide con el de la negativa. La molécula es en conjunto eléctricamente neutra, ya que es igual el número de partículas de uno y otro signo.
El carácter polar o no polar de una molécula puede predecirse; si ambos átomos son iguales, su enlace debe ser no polar, y también lo será la molécula. El grado de polaridad de las moléculas aumenta a medida que los átomos difieren más en su capacidad para arrancar electrones. No resulta tan fácil predecir la naturaleza polar de una molécula compuesta por más de dos átomos, ya que puede ser no polar aunque todos sus enlaces sean individualmente polares.
Electronegatividad
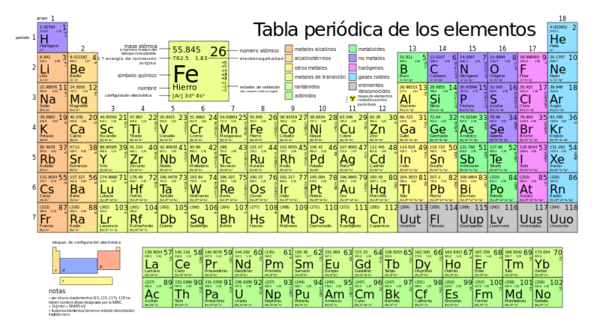
La electronegatividad, se puede definir como la capacidad de un átomo en una molécula para atraer electrones. Sin embargo, debe pensarse que en una molécula cada orbital atómico diferente tiene distinta electronegatividad y que por lo tanto, las electronegatividades atómicas varían de una situación a otra, dependiendo de los orbitales de valencia que se consideren. Además, la electronegatividad de un átomo en una molécula aumenta con capa positiva creciente sobre el otro átomo.
Los valores numéricos asignados a la electronegatividad de los elementos, se miden por la tendencia relativa de un átomo para formar un enlace hasta adquirir un estado negativo; esto es para atraer un par de electrones compartidos. El flúor posee la máxima electronegatividad entre todos los elementos de la tabla periódica.
Los gases inertes no forman normalmente enlaces químicos y, por ello no se les ha asignado número alguno. En general, al recorrer hacia la derecha un periodo hay aumento de la electronegatividad (también aumenta la carga nuclear): los elementos de la extrema izquierda tienen una electronegatividad muy baja; los de la extrema derecha, excepto los del grupo O, poseen elevada electronegatividad. Por lo general, la electronegatividad disminuye de arriba hacia abajo en los grupos a medida que aumenta el tamaño del átomo.
¿Qué utilidad tienen estos valores? Desde luego, pueden usarse para predecir qué enlaces han de ser iónicos y cuáles covalentes. Puesto que la electronegatividad indica la atracción relativa de los átomos hacia los electrones, cabe esperar que dos elementos de electronegatividades muy diferentes, por ejemplo, el sodio (0,9) y el cloro (3,0), formen enlace iónico. Así, de esta propiedad se deduce que los metales alcalinos y los del grupo II deben originar enlaces esencialmente iónicos con los elementos de los grupos VI y VII. En cambio, dos elementos de igual o aproximada electronegatividad, como el cloro (3,0) y el bromo (2,8), es de esperar que se enlacen covalentemente.
La electronegatividad puede utilizarse además para predecir la polaridad de los enlaces covalentes. Cuando más alejados están en la tabla periódica dos elementos electronegativos, más polar será su enlace. Así, el enlace hidrógeno cloro es más polar que el bromo cloro, aunque el átomo de cloro sea el más negativo, por poseer este elemento mayor electronegatividad que el otro.
Enlace iónico
El enlace entre moléculas en las cuales hay transferencia casi completa del electrón, se describe como iónico, es decir, este tipo de enlace se produce entre átomos muy electronegativos y átomos poco electronegativos.
Como los elementos de la izquierda de la tabla periódica tienen, en general, potenciales de ionización bajos, y los de la derecha poseen elevada afinidad electrónica, es lógico que entre ellos se produzcan fácilmente enlaces iónicos. Así que, cualquier metal alcalino (grupo I) puede reaccionar con cualquier halógeno (grupo VII), originando un compuesto iónico. Muchos de los elementos del grupo II reaccionan así mismo con los halógenos o con los elementos del grupo VI formando enlaces iónicos. Generalmente, estos compuestos se parecen al cloruro sódico por ser sólidos, blandos y frágiles a la temperatura ambiente, y porque se disuelven en agua, dando soluciones conductoras de la electricidad. Todos ellos se funden a temperaturas relativamente elevadas.
En resumen, se puede definir de manera concluyente qué:
Un enlace polar, es aquel cuyo enlace tiene un polo negativo y un polo positivo; mientras que, un enlace no polar, es aquel cuyo centro de gravedad de la distribución de carga negativa está en el centro de la molécula. Además, el enlace iónico, es el enlace en moléculas en las cuales hay transferencia casi completa del electrón.
Con respecto a la electronegatividad, se puede decir que los átomos que atraen más fuertemente los electrones de enlace son los electronegativos.
El elemento de la tabla periódica que posee mayor electronegatividad es el flúor.
El enlace iónico se produce entre átomos muy electronegativos y átomos poco electronegativos.
Un enlace polar se ha formado cuando el enlace tiene un polo negativo y el otro polo positivo.
¡Felicitaciones!
Estás participando para optar a la mención especial que se efectuará el domingo 23 de junio del 2019 a las 8:00 pm (hora de Venezuela), gracias a la cual el autor del artículo seleccionado recibirá la cantidad de 1 STEEM transferida a su cuenta.
¡También has recibido 1 ENTROKEN! El token del PROYECTO ENTROPÍA impulsado por la plataforma Steem-Engine.
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Contáctanos en Discord.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Ya se de donde venir a estudiar para cuando tenga un examen! jajaja Excelente post :D
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
This post has been voted on by the SteemSTEM curation team and voting trail. It is elligible for support from @curie.
If you appreciate the work we are doing, then consider supporting our witness stem.witness. Additional witness support to the curie witness would be appreciated as well.
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Please consider setting @steemstem as a beneficiary to your post to get a stronger support.
Please consider using the steemstem.io app to get a stronger support.
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Wow cuanta información, muy bien redactado! Lo entendí todo :)
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Recuerdos del bachillerato pero un poco mas profundo!
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Muchísimas gracias por su gran apoyo
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Congratulations @wayuu-reg! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
You can view your badges on your Steem Board and compare to others on the Steem Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPVote for @Steemitboard as a witness to get one more award and increased upvotes!
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit