Resumen
La cromatografía es una técnica analítica que separa las moléculas de gases o líquidos de una mezcla (en una misma sustancia) por absorción selectiva. Esta técnica está basada en las diferentes velocidades como se mueve cada fluido a través de una sustancia porosa, en la cual las moléculas cargadas positivamente serán la resina y las moléculas de carga negativa son los fluidos). En la práctica se procedió a purificar la lisozima de la clara de huevo a través de la aplicación de la cromatografía de intercambio iónico y la determinación de los perfiles de elusión por espectroscopia en determinada longitud de onda. En dicha práctica se usaron buffers, el Tris-HCl 0,05M a pH 8,2 con un primer pico de absorbancia en el quinto tubo eppendorf, 1 ml, de de 0,058, y dos picos de absorbancia al utilizar el buffer Carbonato-Bicarbonato 0,2M a pH 10,5, en el quinto tubo eppendorf de 1 ml, de 1,4540 y de 2,9725 en el doceavo. Dando como resultado que el primer pico es donde se encuentra la mayor concentración de las otras proteínas presentes en la clara, mientras que el segundo pico es la lisozima ya purificada.
Introducción
Las proteínas suelen tener aminoácidos hidrófilos en su superficie que atraen e interaccionan con moléculas de agua. Esa característica se usa como base para separar proteínas de otras sustancias del extracto. Una manera común y efectiva de separar proteínas y determinar la cantidad de proteína que contiene una muestra es la cromatografía. Los métodos de cromatografía nos permiten clasificar las proteínas según su tamaño o según si tienden a adherirse a otras sustancias o a disolverse en ellas.
En particular en esta práctica se trabajará con la cromatografía de intercambio iónico, siendo éste un método que permite la separación de moléculas basada en sus propiedades de carga eléctrica (ver figura 1). Este tipo de cromatografía se compone de dos fases: la fase estacionaria o intercambiador iónico (resina), y la fase móvil. La fase estacionaria insoluble lleva en la superficie cargas electrostáticas fijas, que retienen contraiones móviles que pueden intercambiarse por iones de la fase móvil (Álvarez y col, 2016).
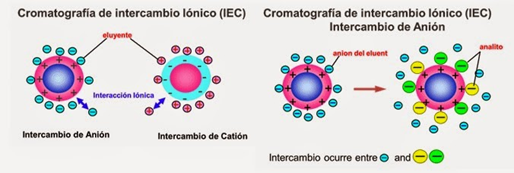
Mayolo Deloisa y col. (2012) en la Revista Mexicana de Ingeniería Química, publicación TÉCNICAS CROMATOGRÁFICAS Y SU APLICACIÓN A ESTUDIOS DE CAMBIOS CONFORMACIONALES, ESTABILIDAD Y REPLEGAMIENTO DE PROTEÍNAS, explican como “Una proteína que no tiene carga neta a un pH equivalente a su punto isoeléctrico (pI) no podrá interactuar con la matriz o fase estacionaria cargada (Figura 2). Sin embargo, a un pH por encima de su punto isoeléctrico una proteína podrá ligarse a una matriz cargada positivamente ´ o intercambiador anionico mientras que a un pH por debajo de su pI, una proteína podrá unirse a ´una matriz cargada negativamente o intercambiador cationico (Handbook GEa 2004; Cummins ´ y col., 2011)”.
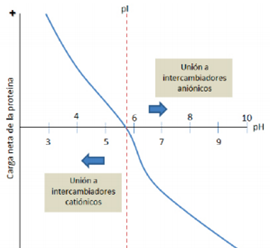 Figura 2. Carga neta de una proteína en función del pH. (Mayolo-Deloisa y col, 2012)
Figura 2. Carga neta de una proteína en función del pH. (Mayolo-Deloisa y col, 2012)
A un pH de 9,5 - 10 la lisozima es prácticamente la única proteína con carga positiva neta. Ello permite separar esta enzima del resto de proteínas mediante la utilización de resinas intercambiadoras, los intercambiadores aniónicos dejaran libre esta enzima mientras que los intercambiadores catiónicos se ligaran a ella (Universidad del País Vasco, 2016)
Por lo tanto, el objetivo de esta práctica fue purificar la enzima (lisozima) de la clara de huevo por cromatografía de intercambio iónico y determinar los perfiles de elución de la corrida cromatográfica, permitiendo llegar a la conclusión de si efectivamente hay mayor cantidad de lisozima o de otras proteínas en la clara del huevo.
Objetivos
• Purificar la enzima lisozima de la clara de huevo por cromatografía de intercambio iónico.
• Determinar los perfiles de elusión de la corrida cromatográfica.
Resultados
A continuación, se presenta la determinación del perfil de elusión, utilizando el espectrofotómetro para medir la absorbancia de los eluyente sostenido de 2 ml en 2 ml. Se midió la absorbancia a 280 nm en el rango ultravioleta.
Tabla 1: Valores de absorbancia obtenidos para el perfil de elusión para buffer Tris-HCL 0,05 M, pH 8,2.
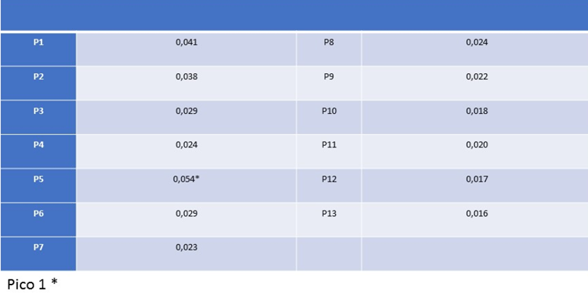
Tabla 2: Valores de absorbancia obtenidos para el perfil de elusión para buffer carbonato-bicarbonato 0,2 M, pH 10,5.
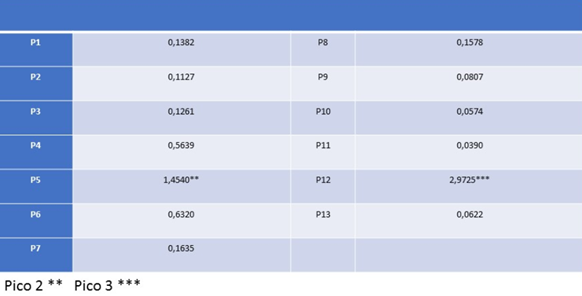
Grafico 1. Resultados y los picos de absorbancia obtenidos en base a los valores de las tablas 1 y 2

Discusión
La cromatografía de intercambio iónico se basa en el principio de que las moléculas cargadas positivamente se adhieren a los intercambiadores negativos y viceversa, es decir de manera reversible; el proceso pasa por dos fases, en la primera se unen al intercambiador que en este caso es la columna (con las condiciones explicadas en la metodología) que generan una unión fuerte, y la segunda etapa, la cual a través de la elusión de buffers con diferentes fuerza iónica (PH específicamente), cuyos componentes del buffer compiten por el lugar de unión, este precipita. La lógica es que al cambiar el PH, de modo de acercarnos al punto isoeléctrico de cada proteína, la carga neta de esta irá disminuyendo y en algún punto dejara de interaccionar con la matriz; sin embargo, esta técnica posee sus desventajas, dado que en este caso las proteínas se eluiran a un PH igual a su punto isoeléctrico, por lo tanto su solubilidad estará disminuida y pueden precipitar.
R + A - es un intercambiador aniónico en la forma A- y B- representa a los aniones en la disolución: R+A- + B+ R+B- + A-
Entre las proteínas de la clara de huevo la lisozima es la única que presenta un punto isoeléctrico > pH 9,5; justamente a un pH entre 9,5 y 10 es la única que posee una carga neta positiva, por esta razón es fácilmente separable del resto de las proteínas de la clara de huevo, puede verse de dos formas: los intercambiadores aniónicos dejaran libre esta enzima o los intercambiadores catiónicos se ligaran a ella.
En la Tabla 1, se pueden observar los valores de absorbancia obtenidos para el perfil de elusión para buffer Tris-HCL 0,05 M, pH 8,2, eluido en una columna con un intercambiador catiónico, la resina de Carboximetil celulosa (CM-52), la cual es negativa. El pico se dio en el quinto tubo eppendorf, 1 ml, cuya absorbancia fue de 0,054 a 280nm en el rango ultravioleta, rango habitual a esta longitud de onda, la cual refleja el punto de eluato donde se observa la mayor concentración de proteínas que no se pegaron a la resina.
Las proteínas pueden no pegarse a la resina por varios motivos, entre los que destacan que:
1. Las condiciones de unión no son las apropiadas, para ello se ajusta el valor del buffer.
2. No se dio suficiente tiempo para permitir la unión, para lo cual hay que disminuir la velocidad de flujo o detenerlo para permitir la incubación.
Finalmente, en la Tabla 2, se ve claramente los valores de absorbancia obtenidos para el perfil de elusión para buffer carbonato-bicarbonato 0,2 M, pH 10,5; en este caso hay un aumento de pH en la columna cromatográfica CM-52, lo que ocasiona que la lisozima sobrepase su punto isoelectrico (el cual es 11), ocurriendo así un cambio de carga neta, provocando la elusión de la muestra. El pico aquí está presente en el quinto tubo eppendorf de 1 ml, cuya absorbancia fue de 1,4540, indicando aquí la mayor concentración de lisozima pura. A su vez ocurrió un caso poco común, habiendo un tercer pico de absorbancia de 2,9725 en el doceavo tubo eppendorf, esto puede haber sucedido en el caso que alguna proteína haya permanecido pegada a la resina.
Referencias Bibliográficas
• Álvarez., Costanzo,. Diaz Zegarra,. Gérez,. Hollman,. Hurtado,. Lucero,. Macuso,. Ruggieri,. Strack,. “Cromatografía de intercambio iónico”. Universidad de Quilmes, Argentina. (Consultado en
http://ufq.unq.edu.ar/Docencia-Virtual/BQblog/Cromatografia%20de%20intercambio%20ionico.pdf el 19/01/2018).
• G. Mendez. Practica 8. Experimento de la lisozima. Facultad de farmacia de la ULA, Mérida, Venezuela. Pag. 97 (Consultado a traves de
http://webdelprofesor.ula.ve/farmacia/gmendez/manuales%20PDF/EXPERIMENTO%208%20LISOZIMA%2006-04.pdf el 19/01/2018)
• Mayolo-Deloisa, K., Martínez, L. M., & Rito-Palomares, M. (2012). Técnicas cromatográficas y su aplicación a estudios de cambios conformacionales, estabilidad y replegamiento de proteínas. Revista mexicana de ingeniería química, 11(3), 415-429.
• Universidad del País Vasco. Purificación de una enzima: La lisozima de huevo. (Consultado a través de
http://www.ehu.eus/biofisica/pdf/practica_5.pdf el 19/01/2018)




