La química nos sorprende con su versatilidad y la variedad de sus aplicaciones y usos. Los procesos que permiten la transformación de la materia son objeto de amplio estudio y llaman la atención de profesionales de diversas áreas, el manejo de bases teóricas es fundamental para identificar los factores que propician esos cambios en la materia.
Pero más allá de la teoría, muchas veces es necesario lo tangible para lograr una mejor compresión de muchos fenómenos.
Ya, en uno de mis post anteriores titulado:
La electrodeposición una herramienta química para la protección de metales contra la corrosion.
Les hable de los conceptos teóricos y la utilización de las reacciones redox en la protección de metales, para complementar dicha información, en esta publicación les demostrare de forma experimental la aplicación de una reacción redox para la obtención de hidróxido cúprico y el galvanizado o electrodeposición del cobre en una placa de hierro.
Reacción óxido reducción cobre-hierro.
 Imagen de elaboración propia
Imagen de elaboración propia

Fundamentos del procedimiento experimental.
Como es bien sabido en una reacción redox ocurren dos procesos de forma simultánea, el de oxidación y el de reducción, los cuales se asocian a la trasferencia o flujo de electrones desde la sustancia que se oxida a la que se reduce, estos procesos pueden ser acelerados mediante la aplicación de electricidad y un medio adecuado para que se generen las reacciones.
En el procedimiento que acá se describe, se forzara la oxidación del cobre ante el hierro presente en una celda electroquímica mediante la aplicación de un voltaje continuo, la reacción se desarrollara en un medio acuoso alcalinizado con NaOH.
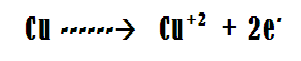
El cobre estará sometido a la carga positiva proveniente de la fuente de poder, actuando en consecuencia como el ánodo de la celda, esto producirá la liberación de sus cationes a la fase acuosa, parte de estos cationes serán atraídos por la carga eléctrica negativa proveniente del cátodo, que en este caso será el hierro y terminaran depositándose en la superficie de este metal. El resto de los cationes presentes en la fase acuosa reaccionan con los OH- aportados por el NaOH, produciendo hidróxido cúprico como se muestra en la siguiente reacción:
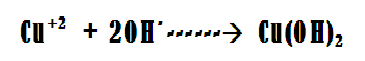
Esquema del procedimiento experimental
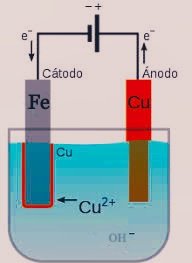 Imagen editada por el autor
Fuente de la imagen original
Imagen editada por el autor
Fuente de la imagen original
Y este compuesto posteriormente se extraerá de la solución acuosa mediante el secado por evaporación.

Reactivos, materiales y equipos a utilizar.
Agua destilada.
Solución concentrada de Hidróxido de sodio o Soda caustica.
Cobre de cable.
Una placa delgada de hierro.
Adaptador o regulador de voltaje (12,5Volt).
Un vaso de precipitado.
Una cápsula de porcelana.
Horno de secado.
Pinzas.
Dos click, teipe y un pedazo de anime.

Descripción del procedimiento.
Inicialmente se procedió a la preparación de la base para la colocación de los electrodos, la cual se elaboró con un pedazo de anime rectangular que se forro con teipe, se le realización dos orificios con una distancia aproximada de 3 cm de separación, por dentro de estos orificios se colocaron posteriormente los electrodos, paras los cuales se utilizó la placa delgada de hierro en el cátodo, y el ánodo de celda se fabricó con el cobre sacado del cable, el cual se enrollo para darle la forma deseada.
 Imagen de elaboración propia
Imagen de elaboración propia
Se hace uso de los clicks para conectar los electrodos de cobre y hierro con los cables de carga positiva y negativa del regulador de voltaje en forma respectiva.
Por otro lado, se procedió a llenar a la mitad el vaso de precipitado con el agua destilada y se le añadió una pequeña cantidad de la solución de soda caustica.
Se conectó el regulador de voltaje a la toma eléctrica y se sumergieron los electrodos en la solución alcalina previamente preparada, de forma inmediata se observó un burbujeo en ambos electrodos, lo cual indico el inició de la reacción.
En la medida en que fue transcurriendo el tiempo se observó como la solución acuosa se tornó a una coloración azulada, indicativo de la presencia de los cationes de cobre.
Coloración azul de la fase acuosa
 Imagen de elaboración propia
Imagen de elaboración propia
Después de una hora de reacción, se observó que había ocurrido la deposición del cobre a lo largo de toda la superficie de la placa de hierro, a pesar de que la solución ya se tornaba azul la intensidad de esta coloración indicaba que aún no se babia llegado a un punto de saturación en cuanto a la concentración de Cu+2.
Se dejó reaccionar por 4 horas más, para asegurar una mayor concentración de cationes de cobre en la solución, en este punto se desmonto el proceso y se transfirió la solución a una cápsula de porcelana.
 Imagen de elaboración propia
Imagen de elaboración propia
Luego se lleva a un horno a 150°C por un lapso de 24 horas para garantizar la evaporación de toda el agua y de esta manera se obtuvo el hidróxido cúprico.
Hidróxido cúprico Cu(OH)2 obtenido una vez se finaliza el experimento
 Imagen de elaboración propia
A continuación en el siguiente vídeo de mi autoría podrán apreciar de forma resumida la realización este procedimiento experimental de principio a fin.
Imagen de elaboración propia
A continuación en el siguiente vídeo de mi autoría podrán apreciar de forma resumida la realización este procedimiento experimental de principio a fin.


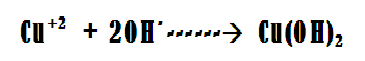










Excelente experimentos amigo José muy didáctico
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Muchas gracias! Me alegra le haya gustado mi demostración.
Saludos!
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
wooooow considero que estos post de ciencia deben ser mas comunes en la comunidad.
De verdad que lo disfrute muchísimo
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Me emociona mucho el que te haya gustado mi publicación, la química y la ciencia en general tienen mucho que ofrecer para el crecimiento e intercambio de conocimientos en esta prestigiosa comunidad.
Gracias por leer y comentar.
¡Saludos!
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Muy buen aporte, un experimento impecable @joseleogon
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Muchas gracias estimada @alexaivytorres viniendo de ud, esas palabras me motivan mucho a seguir compartiendo mis conocimientos con la comunidad.
¡Saludos!
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Excelente trabajo, éxitos.
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
¡Muchas gracias amigo Félix!
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Muy buena la demostración amigo @joseleogon, estas reacciones son muy utiles y bastante demostrativas. Saludos
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Así es, ofrecen una manera practica y didáctica para la enseñanza.
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Hi @joseleogon!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Excelente compañero gran expermento nos has presentado, sin duda alguna la galvanizacion es un procrso muy util en el caso que deseamos proteger metales o bien sea por motivos esteticos como el baño de oro. Asi como los productos obtenidos por la reacciones que se dieron para obtener un reactivo extra. Seras de referencia en un artivulo que tengo montado pro no terminado para obtener sulfato de cobre.
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Muchas gracias colega, oye que interesante vas trabajar en la obtención de sulfato de cobre, espero ver pronto esa publicación.
Saludos
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Saludos amigo @joseleogon, limpia la estructura del manuscrito, impecable el procedimiento metodológico. Felicitaciones, un post de calidad desde Stem-espanol que sigue incrementando el nivel académico de las publicaciones en Steemit.
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Me motiva la receptividad que han mostrado los miembros de la comunidad. Gracias por el apoyo.
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Es necesario que en steemit se aprenda a valorar mejor el contenido científico y que aporte al conocimiento. Si seguimos trabajando en ello sin desviarnos podemos consolidarnos como una de las mejores comunidades de la plataforma.
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
excelente men te felicito !
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Muchas gracias amigo!
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Realmente no dejas de sorprendernos con tus experimentos. Un abrazo amigo
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
La química es hermosa y la podemos encontrar en casi todo lo que nos rodea. Grandioso experimento mi estimado @joseleogon, siempre nos traes contenido didáctico e interesante. Muchas gracias por compartirlo con nosotros, saludos.
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Cuando se hace la electrólisis de Cu para obtener una muestra de alta calidad de pureza, las impurezas caen al fondo del contenedor y es una forma útil de obtener material secundario como lo hiciste aquí con el hidróxido cúprico.
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Por lo general el producto secundario que se forma en esta reacción es oxido cúprico pero al calentar termina reaccionando con los OH provenientes del hidróxido de sodio. Por eso en el vídeo y en el post hice la aclaratoria de que este procedimiento era con fines demostrativos, porque no determine la cantidad de impurezas que pueden originarse durante el proceso.
Gracias por leer y comentar amigo.
Saludos!
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Sería interesante analizar la pureza del hidróxido cúprico obtenido por este meto, pero ese ya seria material para otro post jajaja...
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit