La calorimetría.
Es una técnica de análisis que se fundamenta en la medición de los cambios de energía calorífica que ocurren durante una reacción química, sea esta exotérmica o endotérmica.
Calorímetro Isobárico
Fuente
Cuando los cambios de energía se dan a presión constante, como ocurre en la mayoría de los casos, el calor sera igual a la energía intercambiada entre un determinado sistema y su entorno, es decir al cambio de entalpías.
Q = ΔH
dónde:
Q: Calor.
ΔH: Diferencial de entalpías.
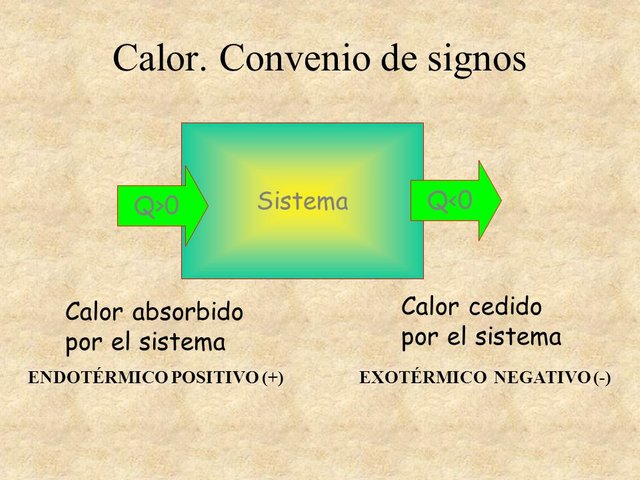
Durante una reacción química la liberación de energía al entorno significará que el sistema pierde energía, por consiguiente el diferencial entalpías sera negativo, caso contrario ocurre cuando para llevarse acabo la reacción se absorbe calor del entorno y los productos obtenidos presentan una mayor energía interna que los reactivos de partida. Cada sustancia puede absorber calor en mayor o en menor grado, esa capacidad que tienen las sustancias a absorber calor sin que su temperatura se vea afectada, es la que se conoce como capacidad calorífica.
Absorción y liberación de calor
Fuente
Los cambios de entalpías están definidos por las variaciones de las temperaturas, ya que mientras mayor sea la energía interna de las moléculas habrá mas rose entre ellas y una mayor cinética en las interacciones de estas, aumentando la temperatura. Por lo cual los cambios de entalpías quedarían definidos por una relación entre la capacidad calorífica de las sustancias que reaccionan y el diferencial de temperatura generado en la reacción, como se muestra en la siguiente ecuación:
dónde:
H1: Entalpía antes de la reacción.
H2: Entalpía después de la reacción.
Cp: Capacidad calorífica.
La capacidad calorífica esta dada función de la temperatura, siendo T1 la temperatura de inició y T2 la temperatura final, por tanto al resolver la integral obtenemos que:
dónde:
ΔH: Diferencial de entalpías.
ΔT: Diferencial de temperatura (T2 - T1).
Cp: Capacidad calorífica.
Debido a que las capacidades caloríficas vienen tabuladas teóricamente en función a un gramo, cuando se requiera calcular el cambio de entalpía de una cantidad mayor de sustancia, deberá multiplicarse por la masa, quedando la ecuación de la siguiente manera.
Q = ∆H = m × Cp ×∆T
dónde:
Q: Calor.
ΔH: Diferencial de entalpías.
m: Masa de la sustancia.
ΔT: Diferencial de temperatura (T2 - T1).
Cp: Capacidad calorífica.
De acuerdo al principio de conservación de la energía esta no se crea ni se destruye, simplemente sufre modificaciones, en el caso del calor este pasa de un cuerpo a otros, por lo que es valido decir que el calor emitido por un sistema sera igual al calor absorbido por su entorno.
Basado en esto pueden realizarse determinaciones de la cantidad de calor emitida o absorbida durante reacciones químicas conociendo los componentes del sistema en reacción, pero a la vez si no se posee suficiente información del sistema pudiera determinarse el calor de la reacción al definir la cantidad de calor que gana o pierde el entorno, siempre y cuando no existan factores generadores de perdidas de calor.
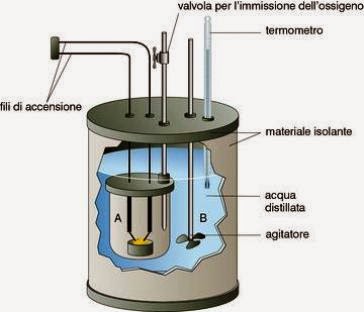
Calorímetro
Es un sistema que permite determinar el flujo del calor liberado, o absorbido al ocurrir una reacción.
Una de las reacciones que produce mayor generación de calor es la combustión, es en tal sentido, que la mayoría de los calorímetros han sido diseñados para propiciar una reacción de combustión en su interior, y determinar los cambios de temperatura que esta reacción produce en un entorno definido, el cual a su vez se encuentra resguardado con un material aislante, para evitar los errores de perdida o difusión del calor.
Calorímetro de laboratorio
Fuente
Por lo general se utiliza el agua como la sustancia que absorbe calor y constituye el entorno al sistema en reacción. El agua recubrirá al sistema donde se lleva acabo la combustión, y al producirse esta, el calor generado pasa al agua, si inicialmente conocemos la temperatura del agua antes de ocurrir la reacción, y luego obtenemos la temperatura una vez esta ha ocurrido, podemos calcular el calor que esta ha absorbido si conocemos su masa, y por consiguiente el calor que absorbe el agua sera igual al liberado por el sistema en reacción.
Determinación del contenido calórico de los alimentos
A todos nos interesa conocer el aporte energético que nos suministran los distintos alimentos,la información nutricional y cuantas calorías estamos ingiriendo. La calorimetría nos ofrece la respuesta a esa interrogante, una caloría equivale al calor necesario para hacer aumentar 1 °C la temperatura de 1 gramo de agua, es por ello que a través de un balance energético en donde esta interactúe podemos determinar las calorías presentes en un alimento.
Determinación de las calorías
Cuando se requiere determinar el valor calórico de un alimento, se toma una cantidad determinada del mismo y se comprime en forma de pastilla, la cual sera introducida en la cámara de combustión interna del equipo calorimétrico, esta cámara de combustión se sumerge en una masa conocida de agua la cual se encuentra en un deposito recubierto por un material aislante, se procede realizar la combustión por ignición eléctrica, y se miden las diferencias en la temperatura del agua antes de iniciar la combustión y una vez que esta se da.
El contenido calórico del alimento sera igual al calor absorbido por el agua durante la combustión del mismo, y debido a que el proceso se lleva acabo a presión constante, podemos decir que el contenido calórico del alimento sera proporcional a la energía interna absorbida por el agua, por consiguiente.
Contenido Calórico= ∆H = mH2O × CpH2O ×∆T
dónde:
m: Masa del agua en gramos.
ΔT: Diferencial de temperaturas (T2 - T1).
Cp: Capacidad calorífica del agua.
Y de esta manera a través de la utilización de la termodinámica podemos determinar este parametro que cada día es mas importante conocer en los alimentos.
De hecho hasta por fines legales es obligatorio que los alimentos envasados lleven una tabla de información nutricional en donde aparte de los nutrientes se especifique el aporte energético de los mismo, según lo establecido en la legislación Venezolana que cita la NORMA COVENIN 2952/1:1997 donde se dan las pautas y directrices para la declaración de propiedades nutricionales y de salud en el rotulado de los alimentos envasados.
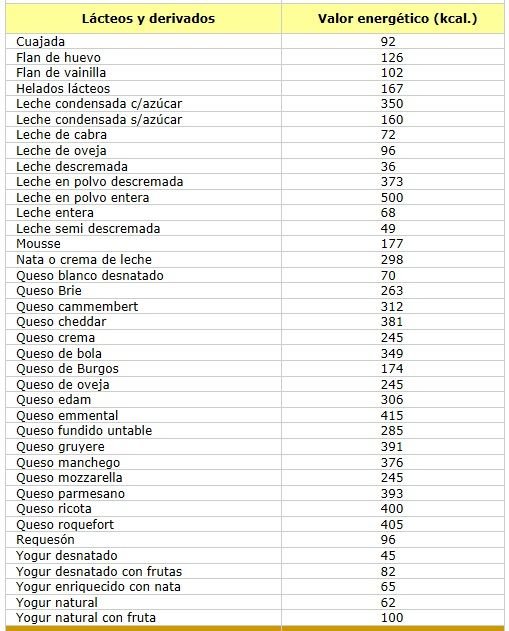
Contenido energético de algunos grupos de alimentos
Lácteos
Fuente
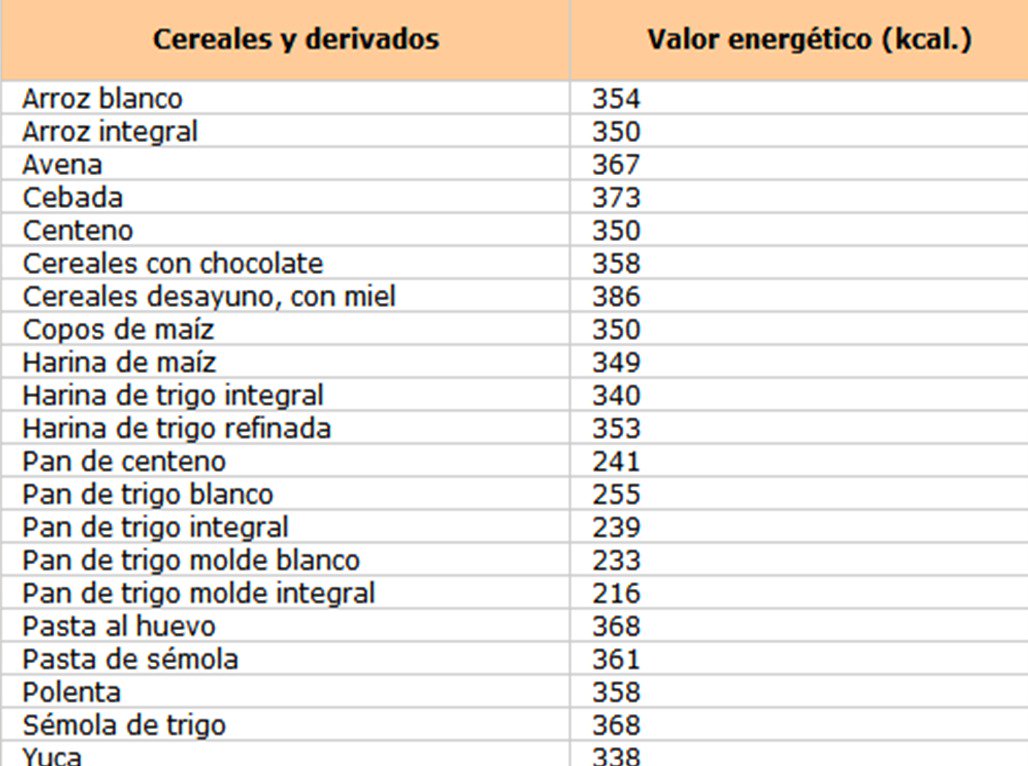
Cereales
Fuente
Acá les dejo estos vídeos complementarios donde se demuestra de forma sencilla lo que significan las calorías en los alimentos.
Las Calorías
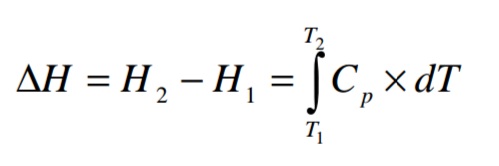
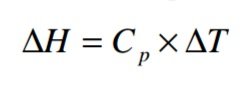


Siendo un SteemStem Estados
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Que bien, trae muchos recuerdos de las prácticas de laboratorio. también resulta muy útil para determinar el calor de solución, buen post.
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Así es amigo, esta técnica es aplicable para determinar los calores de disolución, calores de reacción e inclusive las capacidades caloríficas de las sustancias por medio de balances de energía.
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Excelente informaciòn, todos tus post son muy interesantes
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Me alegra mucho que te gusten, gracias por leer y comentar. Saludos!
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit