Saludos estimada comunidad de #Stem-espanol y #Steemit, hoy quiero compartir con ustedes una investigación que hice recientemente sobre nuestro vital líquido. EL AGUA puede contener diversos minerales, particularmente sales de magnesio y calcio, si la concentración de estos minerales es muy elevada se considera entonces como agua dura, la cual se expresa en equivalentes de carbonato de calcio y representa un importante factor de calidad del agua.
Introducción
Se considera la dureza del agua, como la cantidad de iones presentes en el agua particularmente iones de calcio y magnesio. La dureza del agua es perjudicial ya que el elevado contenido de carbonatos produce incrustaciones en tuberías en equipos tanto domésticos como industriales disminuyendo así su tiempo de vida útil, otros de los problemas que genera el agua dura a nivel doméstico es que la generación de espuma al contacto con el detergente desciende considerablemente, ya que tanto el magnesio como el calcio reaccionan químicamente con los compuestos que forman el detergente dejándolo inefectivo, por lo cual es necesario añadir más detergente si el agua es dura.

En la tabla 1 se muestra la clasificación de la dureza del agua en función de la concentración de carbonato de calcio.
| Tipo de agua | mg/L de dureza |
|---|---|
| Suave | 0-75 |
| Moderadamente dura | 75-150 |
| Dura | 150-300 |
| Muy dura | >300 |
Previo a su captación, el agua a traviesa formaciones geológicas lo cual determina la dureza del agua, si el agua pasa por calizas que son acuíferos carbonatados, tendrá un elevado contenido de estos minerales (calcio y magnesio), en caso contrario de aguas subterráneas que provienen de acuíferos silicatados como el granito poseen bajo contenidos de calcio y magnesio.
La dureza puede estar en el agua de manera permanente o temporal, en el caso de la dureza temporal debida a carbonatos en forma de bicarbonatos es muy simple de suprimirla con solo llevar el agua a su punto de ebullición, precipitara el carbonato de calcio y tras una filtración se pueden eliminar estos iones dejando el agua considerablemente más blanda. Los cloruros y sulfatos de Mg y Ca son los responsables de la dureza permanente ya que estos son solubles al aumentar la temperatura no pueden separarse de igual forma, en este caso se usan otros procesos.
La determinación de la dureza del agua constituye un importante parámetro de calidad por lo cual resulta relevante para procesos industriales ya que permite ajustar el funcionamiento de equipos para evitar daños como incrustaciones o bien diseñar métodos que permitan eliminar la presencia de calcio y magnesio para obtener un agua blanda.
En este estudio se determinó la dureza del agua mediante una valoración de complexometrica usando como agente titulante EDTA ácido etilendiaminotetraacético. Se analizaron dos muestra de agua una domestica proveniente de la localidad de Caja Seca y una muestra de agua mineral comercial “Valle Verde”.
Parte Experimental
Reactivos utilizados
- EDTA ácido etilendiaminotetraacético
- Cloruro de calcio dihidratado (CaCl2.2H2O) 0,01 M
- Sulfato de magnesio (MgSO4) 0,01 M
- Solución reguladora amoniacal de pH (NH4OH/NH4Cl)
- Indicador Negro de Eriocromo T
- Indicador Murexida
Metodología
La solución de EDTA previamente estandarizada y por lo tanto en conocimiento de su concentración molar real se usó como agente titulante para la determinación de la dureza del agua. Las muestras seleccionadas fueron agua domestica de Caja Seca y agua mineral “Valle Verde”. Se prepararon 6 muestras de 10 mL de agua doméstica y 6 de agua mineral, y se añadieron a cada una de ellas: 5 mL de solución reguladora amoniacal y 5 gotas de solución de sulfato de magnesio. Las muestras fueron dividas en 2 grupos de tres alícuotas, al primer grupo se le añadió un poco del indicador Negro de Eriocromo en estado sólido y al otro grupo se adiciono Murexida como indicador. Posteriormente se procedió a titular cada alícuota con EDTA hasta el viraje correspondiente de los indicadores; los blancos se utilizaron como medio de referencia para ajustar los puntos finales.
En esta experiencia se usaron dos indicadores para la determinación de los iones de calcio y magnesio, debido a que el indicador Negro de Eriocromo T es útil cuando están presentes ambos iones (calcio y magnesio) dureza total, mientras que el indicador Murexida solo determina iones calcio (dureza cálcica).
| Indicador | Límites útiles de pH | Útil para |
| Negro de Eriocromo T | 7,5 - 10,5 | Ba, Ca, Mg, Zn |
| Murexida | 6 – 13 | Ca, Ni, Cu |
Resultados y Discusión
En una valoración Complexométrica ocurre la formación de un complejo o compuesto de coordinación con un catión metálico de la muestra en estudio, muchos cationes pueden reaccionan con ligando (especies donadoras de electrones) para formar dichos complejos. Existen complejos de coordinación denominados quelatos caracterizados por tener en su estructura anillos heterocíclicos por proporcionan una mayor estabilidad, los cuales se forman cuando los ligando poseen dos o más grupos dadores.
El Ácido Etilendiaminotetracético (EDTA) es uno de los compuestos orgánicos más conocidos que forma quelatos estables cationes metálicos, es una amina terciaria con seis tipos de coordinación distintos. El EDTA es usado para determinar la dureza del agua como agente titulante. La dureza se conoce como la concentración de carbonato de calcio que es equivalente químicamente a la concentración de cationes polivalentes disueltos en la muestra, los cuales suelen ser calcio y magnesio, el segundo en menor medida.
La determinación de la dureza total en aguas doméstica y comerciales se llevó a cabo a través de la titulación complexometrica usando el indicador Negro de Eriocromo T, el punto final de la valoración lo determino el cambio de color de violeta a azul, el cual ocurre cuando los iones metálicos son totalmente complejados por el EDTA. Debido a que los quelatos del calcio-EDTA se forman con una estequiometría de 1:1, es posible establecer milimoles de Ca = milimoles de EDTA. Se calcularon las concentraciones dadas por cada alícuota dividiendo los milimoles de EDTA entre los mililitros de solución utilizados.

Posteriormente se utilizó Murexida como indicador. Antes de añadir la solución de EDTA, el color del complejo indicador-metal era rojo. Al alcanzar el punto final de la titulación, la solución se tornó violeta, debido a que los iones metálicos fueron totalmente complejados por el EDTA.

La titulación con NET, sólo permitió conocer la dureza total del agua. Sin embargo, los resultados que se obtiene a través de este experimento no permiten diferenciar el papel que cumplen los dos cationes ‘mayoritarios’, calcio y magnesio, en la dureza. Por ello se llevó a cabo una segunda titulación en donde se utilizó Murexida como indicador, el indicador permitió sólo determinar la cantidad de ion calcio en la muestra.
Una vez obtenida la dureza total y cálcica, se calculó la dureza magnésica, ya que la dureza del agua la determinan los cationes Ca2+ y Mg2+, de la suma de ambos cationes resulta la dureza total. La dureza magnésica se obtiene al restar el valor de la dureza cálcica a la dureza total. En la tabla a continuación se muestran los resultados.
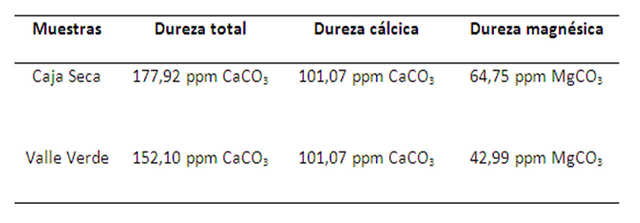
Como se observa en la tabla 3, el agua mineral comercial es menos dura que el agua doméstica, lo cual se debe a la serie de tratamientos de purificación a la que es sometida antes de comercializarse. Según la Norma Venezolana Covenin 2771-91 bajo el nombre de: “Aguas naturales, industriales y residuales. Determinación de dureza” (Tabla 1), ambas muestras analizadas pertenecen a la categoría de agua dura, este tipo de aguas puede generar incrustaciones en tuberías con el aumento de la temperatura, generando así el deterioro de las mismas, a nivel industrial ocasiona serios problemas en calderas y otras unidades en las que el agua sufre un aumento de temperatura.
Conclusiones
- El método de Volumetría Complexométrica es efectivo para la determinación de la dureza del agua.
- La dureza del agua se debe a la presencia de iones metálicos polivalentes, siendo los iones calcio y magnesio los mayoritarios.
- Las aguas analizadas pertenecen a la categoría de agua dura, ya que la cantidad de ppm de CaCO3 se encuentra entre 150-300 ppm de CaCO3
Referencias
H. Franson. ¨Métodos de normalización para el análisis de aguas potables y residuales. Editorial Díaz de Santos. México, 1992. Pág. 257-259.
Skoog, D., West, D., Holler, F., Crouch, S. (2005). Capítulo 17: reacciones y valoraciones de formación de complejos en “Fundamentos de la Química Analítica”. Octava edición. Editorial Thomson. Páginas 457-458.
NALCO. ¨Manual del agua, su naturaleza, tratamiento y aplicaciones¨. Tomo III. Mc Graw Hill 1989.
Skoog, D; West, D. (1980) Capítulo 12: volumetrías de formación de complejos, en “introducción a la química analítica”. Editorial Reverté, s.a. Pág. 255-259
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit
Hi @rossyholg!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Downvoting a post can decrease pending rewards and make it less visible. Common reasons:
Submit