Este es un concepto útil en el laboratorio para estudiar las relaciones de masa entre los átomos y las moléculas, lo que permite entender cómo se componen los compuestos. Pero, un átomo es una partícula extremadamente pequeña, tan solo en una partícula de polvo existen millones de átomos, es claro que no es posible medir su masa, por lo que se recurre a métodos experimentales para determinar su masa en relación con la de otro elemento, al cual, se le asigna un valor de masa y se utiliza de referencia.
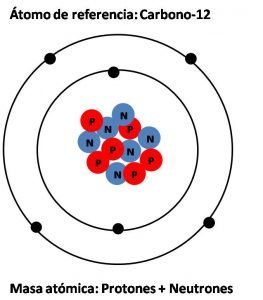
Específicamente, la masa atómica, es la masa de un átomo expresado en unidades de masa atómica (uma). Y una unidad de masa atómica se define como una masa exactamente igual a la doceava parte de la masa de un átomo de carbono-12; el cual es el isotopo de carbono que tiene 6 protones y seis neutrones en su núcleo. Así, el átomo de carbono-12 se utiliza como átomo de referencia para establecer la escala de asignación de las masas atómicas de los demás elementos, y su masa queda establecida por acuerdo en 12 uma. De este modo, como se puede establecer experimentalmente que un átomo de hidrógeno tiene un 8,4% de la masa de un átomo de carbono-12, entonces su masa atómica es de 0,084x12uma, es decir 1,008 uma, de forma semejante, al decir que la masa atómica de un átomo de sodio es 22,99 estamos diciendo que es casi 23 veces más pesado que un átomo de hidrógeno.
A veces podemos ver que el término es utilizado indistintamente como peso atómico; aunque en física, el término peso expresa la fuerza ejercida por un campo gravitatorio y se expresa en unidades de Newton, pero se suelen utilizar como sinónimos aunque corresponden signficados distintos.
Masa atómica promedio
Por ejemplo, sabiendo que la abundancia natural de los isotopos del hierro es 93% el 56Fe, 5% 54Fe y 2% de 57Fe, la masa atómica del átomo de hierro se establece como:
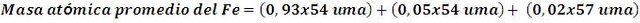
Así, la masa atómica del hierro es 55,92 uma aproximadamente.
Algunas consideraciones

Referencias:
Chang, R. Química general. Editorial Mc-Graw Gill.
Wikipedia.com. Masa atómica
Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2018/12/masa-atomica